Природные воды представляют собой естественные растворы. Важнейшей характеристикой природных вод является их солевой состав, определяющий воздействие биогенных элементов на живой организм. Природные воды содержат, как правило, в своем составе ионы тяжелых металлов – железо, свинец, медь, марганец, цинк, никель, кадмий и др. Соединения металлов вредно влияют на экосистему водоем-почва-растение-животный мир-человек.
Существуют различные способы очистки воды от соединений тяжелых металлов. Наиболее перспективной является сорбционная технология очистки природных и сточных вод. В качестве сорбентов для катионов металлов из водных растворов используют различные искусственные и природные пористые материалы, имеющие развитую или специфическую поверхность. Актуальной задачей является использование местных природных сорбентов, обладающих высокой сорбционной емкостью. Природные сорбенты имеют невысокую стоимость, достаточную глубину очистки по отношению к ионам металлов и могут быть использованы для решения вопросов защиты окружающей среды. Целью настоящей работы является изучение сорбционной активности каолинита по отношению к ионам марганца (II).
Процесс ионного обмена на пористых сорбентах является сложным и многостадийным процессом. На сорбционную способность каолинита влияет природа их обменного комплекса. В результате замены одних ионов на другие можно изменять свойства поверхности каолинита.
Природный каолинит представляет собой равномерное распределение высокодисперсных кристаллических силикатных частиц [1]. Кристаллическая решетка состоит из двухслойных пакетов, в которых на одну сетку октаэдров приходится одна сетка кремнекислородных тетраэдров. Расстояние между тетраэдрическими и октаэдрическими слоями постоянно и равно 0,28 нм. Расстояние между пакетами составляет 0,72 нм. Кристаллики каолинита имеют вид хорошо выраженных шестиугольников размером до 0,3–0,4 мкм и толщиной 0,05–2,00 мкм, что соответствует удельной поверхности 1–22 м2/г.
Сорбцию ионов марганца (II) изучали из нитратных растворов с концентрациями 0,01; 0,02; 0,04; 0,06; 0,08 и 0,1 моль/л. Значение рН растворов в контакте с сорбентом во всех случаях не превышало 6,7. Эксперименты проводили при температуре 25±1 °С. Использовали каолинит в нативной (природной форме) и химически модифицированной: Н-форма (каолинит обработан соляной кислотой); солевая Na-форма (обработан NaCl); ОН-форма (обработан гидроксидом натрия).
Сорбцию ионов марганца в статических условиях проводили методом переменных концентраций. Для этого сорбент в соответствующей ионной форме помещали в виде отдельных навесок массой 1,0 г в колбы с притертыми пробками на 100 мл. Каждую колбу с навеской сорбента заливали 50 мл раствора, содержащего исследуемый ион различной концентрации. Сорбент в контакте с исследуемым раствором выдерживали в течение 7 суток. Затем отбирали аликвоты и определяли содержание поглощенных ионов по разности между концентрациями исходного и равновесного растворов. Концентрацию ионов марганца в растворах определяли комплексонометрическим титрованием с индикатором эриохромом.
О сорбционных свойствах каолинита можно судить по изотермам, характеризующим зависимость сорбционной способности его от концентрации в растворе ионов марганца (II). Количественная адсорбция (Г) определяется избытком ионов на границе фаз по сравнению с равновесным количеством данных ионов в растворе. Экспериментально величину адсорбции ионов вычисляли по уравнению:
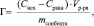
где Сисх – исходная концентрация ионов марганца (II) в растворе, ммоль/л; Сравн – равновесная концентрация ионов марганца (II), ммоль/л; Vр-ра – объем раствора, л; mсорбента – масса сорбента, г.
Для установления закономерностей сорбции ионов марганца (II) на каолините было изучено влияние концентрации исходного раствора и формы каолинита на величину сорбции. В результате было установлено, что с увеличением концентрации ионов марганца (II) возрастает величина удельной сорбции. Полученные данные показывают, что солевая, щелочная и кислотная обработка каолинита приводит к увеличению сорбируемости ионов марганца (II), по отношению к исходному сорбенту. Сорбционная емкость в солевой форме – 0,44; щелочной – 3,03; кислотной – 0,10; нативной – 0,031 ммоль/г.
В результате сорбции наблюдается конкуренция двух видов межмолекулярных взаимодействий: гидратация ионов металлов и взаимодействие ионов металлов с сорбентом [2]. С увеличением концентрации сорбция на исходном каолините возрастает и в области 0,1 ммоль/мл наблюдается перегиб, указывающий на изменение механизма сорбции. На первой ступени сорбции марганца (II) предельное значение не достигается и выше отмеченной концентрации сорбция проходит одновременно на различных активных центрах.
На второй ступени сорбции ионов марганца (II) также происходит по ионообменному механизму, но на менее доступных активных центрах, находящихся в участках каолинита с более высокой степенью дисперсности.
Изотермы сорбции ионов марганца (II) принадлежат к изотермам IV типа по классификации БЭТ [3], которым характерна конечная адсорбция при приближении к насыщению концентрации.
Глубина сорбционного извлечения марганца из природных вод определяется большим количеством факторов, которые легко регулируются при технологической реализации процесса. К этим факторам можно отнести удельную массу сорбента, предварительную его подготовку (перевод в солевую форму), рН растворов, линейную скорость потока. Особое значение имеет высота слоя сорбента и его фракционный состав.
В заключении следует отметить, что каолинит в щелочной форме обладает более высокой сорбционной способностью по отношению к ионам марганца (II) по сравнению с нативной формой каолинитом.
По величине сорбционной способности каолинит в разных формах можно расположить в ряд: ОН-форма > Na-форма > Н – форма > нативная форма каолинита.
Библиографическая ссылка
Пимнева Л.А., Казанцева A.А. ИЗВЛЕЧЕНИЯ МАРГАНЦА (II) ИЗ ПРИРОДНЫХ ВОД // Международный журнал экспериментального образования. – 2016. – № 10-1. – С. 57-58;URL: https://expeducation.ru/ru/article/view?id=10550 (дата обращения: 20.04.2024).

